新型コロナウイルスに関するPCR検査のあれこれを書いてみた
2020-02-29
このエントリは
新型コロナウイルスの対処法とかあれこれ書いてみた
新型コロナウイルスの検査法の感度ややり方について書いてみた
ダイヤモンドプリンセス号に潜入した岩田氏の動画のあれこれを解説してみた
新型コロナウイルスの病原体検出マニュアルをチェックしてみた
の続きです。
新型コロナウイルスの病原体検出マニュアルをチェックしてみたについての質問や疑問、いちゃもんがたくさん来ていたので、私ならこうする!の部分をこのエントリに移植して解説していきたいと思います。
Contents
簡便なPCR検査の必要性
PCR検査とは
そもそもPCR検査とは、新型コロナウイルスの検査法の感度ややり方について書いてみたでも解説した通り、ウイルスの遺伝情報の一部を増幅できるかどうか?をチェックし、
ウイルス特有のDNAを増幅できたら陽性→ウイルスに感染している
ウイルス特有のDNAを増幅できなかったら陰性→ウイルスに感染していない
という判断をするための検査です。
この検査方法は、患者さんの痰や、喉の奥や鼻の奥の粘膜にいるであろうと思われるウイルスをぬぐい取り、痰やぬぐい液中のウイルスの中にあるRNAを抽出し、そのRNAをRT(リバーストランスクリプション:逆転写)でDNAに変換し、そのDNAをPCR(DNA増幅反応)で増幅する。というものです。
PCR検査用の検体は医師か本人しか採れない
患者さんから検体を採取するわけですから、これができるのはお医者さん、もしくは本人だけです。
一般の人が他人の検体を採取することはできません。
そして、その検体の中にはウイルスがいるかもしれないわけですから、ウイルスに感染しないようにするための予防策も必要です。
今回の新型コロナウイルスはインフルエンザウイルスとほぼ同等の扱いなので、クリニックとかでインフルエンザウイルスをチェックするのと同様にお医者さんであれば簡単に採取することができます。
もちろん、感染しないようにする手袋とかゴーグルとかは必要です。
新型コロナウイルスの判定キットはまだ無い
新型コロナウイルスにはインフルエンザウイルスの判定キットみたいに、検体をポンと置いたら感染しているかしていないかがわかるような簡易検査キットはありません。
だから、感染しているかどうかの確定はPCR検査をするしか方法がありません。
(実際はその後、シーケンスを行います。)
しかしながら、今までのPCR検査というものは、肝炎ウイルスのチェックとか日本脳炎のチェックとかで時々使用するようなもので、インフルの簡易キットのように頻繁に使用されているものではないようです。
PCR検査をしたら医療崩壊?
理学部で研究をしていた私からしてみれば、PCRを一日に数十サンプルするのはごく日常で、ハサミを使うよりも頻繁に使用していたのでなんら難しいことではないのですが、お医者さんからしてみたら、検体を採取して、民間の検査会社に輸送して、民間の検査会社でPCRして、そこから結果をもらう。という手順を踏むと思うので、書類とか書かないといけないし、梱包にも時間かかるし、検査結果が出るまでに数日かかることもあるので、忙しいときにはやりたくないでしょう。
なので、「これ以上医者の手を煩わさせるな!希望者全員検査していたら医療崩壊するぞ!」という反応になっているのだと思います。
そもそも、お医者さん自身がPCRするわけじゃないのでお医者さんはPCRのやり方を知らないと思います。
そもそも、希望者全員検査しろなんて上(かみ)昌広医師意外は誰も言ってないと思うのですが、なぜかたくさんの人が言った事にされているようです。
ちなみに、私は濃厚接触者や肺炎患者さんなどは検査しろとは言いましたが、希望者全員検査しろなんて言ってません。
ていうか、全員検査しろ!なんて言ってる人いないのに、「全員検査なんて無駄だ!」って言ってる人、誰に向かって言ってるんだろう?
— いいな (@iina_kobe) February 25, 2020
はい。だから、私が言っていたように、濃厚接触者を隔離して、症状がなくても全員検査すべきやったんですが、もうすでに遅いので、今からは肺炎の人とか妊婦とか疾患のある人のみ、検査するしかないですね。
— いいな (@iina_kobe) February 26, 2020
PCR検査は時間がかかるのでできない?
PCRには最短でも4~6時間かかる。
という報道がなされておりますね。
確かに、新型コロナウイルスの病原体検出マニュアルをチェックしてみたでも書いた通り、厚労省の出した2ステップPCRの方法では、ネスティッドPCRもしているので、2時間のPCRを二回することになり4時間。検体からのRNA抽出に1~2時間かかるっぽい(輸送も入れたら一日以上かかる)ので、最短で4~6時間ってのは妥当でしょう。
しかし、こんなことするアホは研究者にはいません。。。
しかしながら、数日前の報道でも出ています通り、RNAの抽出15分→RTPCR15分の合計30分で結果が出るという最新のスマートアンプ法というPCRもあります。
政府はこれを三月中にはじめようとしていますね。
私は2.16の時点で言ってますね。
RTRTPCRでいいんじゃね?リバトラリアタイPCR。15分でチェックできるし。
— いいな (@iina_kobe) February 16, 2020
お医者さんが、手間がかかることをやらすな!って言ってますけども、それはPCR検査がしんどいと思い込んでいるからだと個人的には思っています。
もし、RNAの抽出込みで30分で簡単に検査ができたら、お医者さんの対応も変わると思うんですね。
しかも、手間的には5分もかからず、30分後に結果を見るだけですから。
病院には、風邪気味だといって新型コロナ感染者の人が来院してくる可能性もあるわけで、そこですぐに新型コロナウイルスだと判定できれば余計な院内感染も防げますし、その人に自宅待機を命じることもできるわけですから、理想のケースとなると思われます。
それが可能な状況になれば、軽微な熱で医者に来ないで!なんていうこともなくなると思います。
そもそも、小さな子供がいる家庭では、子供に熱があると心配ですぐに医者に行きますからね。それを自宅で三日間待機してくれとか言われても、無茶です。
現在の感染研(厚労省)の出している普通のRTPCR検査の不備について
RNA抽出の不備
感染研が作って厚労省の出しているPCRの感度は30%~50%と言われています。
私がやっていたRTPCRは、ほぼ100%かかっていました。
神戸大学医学部で検体からRTPCRを現在行っている人も100%かかる。といっているので、ので、このPCRの感度は30%~50%は不思議でしょうがありません。
今回の感染研のプロトコルではないのですが、
February 22, 2020
Inactivating porcine coronavirus before nuclei acid isolation with the temperature higher than 56 °C damages its genome integrity seriously
では、なんでか検体採取後のRNAを56℃や92℃にして、わざわざRNAを壊しちゃっているようです。
なんでこんなことをしているのかわかりません。
わかる人がいたら教えてください。
新型コロナウイルスPCR検査のpositive rateが現状30-50%と低めな原因として、PCR前の加熱処理がウイルスの安定性に大きな影響を与えているとの研究がBioRxivにて発表。標準の保存液では56度30分間の加熱では約50%、92度5分間では約3%まで低下。試料保存液の改善が必要と提案。https://t.co/mfbWwlUXmM
— HattoriM@家にいましょう (@HattoriM) February 23, 2020
感染研のプロトコルでも、なぜかPBS-DTT液で室温で15分間置く。なんていう意味不明な方法を使用しています。

そもそも痰なんかにはRNAを壊すRNaseが大量に存在しているのに、RNAの分解を阻害するRNase inhibitorも入れずに15分も放置してRNAをわざわざ壊しているこの理由がわかる人、教えてください。
ちなみにDTTによるジスルフィド結合の切断には15分も要りませんので、それ以外の理由でお願いします。
まあ、この方法だと、RNAを抽出する以前に大量のおそらく50%程度のRNAが壊れてしまっているでしょう。
私ならpH8.0のTEにDNaseとRNAinhibitorを入れたものを検体の採取に使用し、そのままISOGENとかTRIzol処理しますね。
リバーストランスクリプション(RT)の不備
RNAの抽出はRNA抽出キットを使用しているので、問題なく行われているようですが、問題はそのあとのRTです。(RTについては新型コロナウイルスの検査法の感度ややり方について書いてみたをお読みください。)
感染研の提示している2-step RT-PCR法では、RTにOligo(dT)12–18 Primer(オリゴdTプライマー)とRandom Hexamers(ランダムプライマー)が使用されております。
新型コロナウイルスの病原体検出マニュアルをチェックしてみたの厚労省のマニュアルに、致命的な欠陥が見つかりました。2020.2.25追記でも書きましたが、普通は、ランダムプライマーやオリゴdTプライマーなんかは使用せず、スペシフィックなプライマーを使用します。
ランダムプライマーやオリゴdTプライマーは、RNA全体をクローニングしたいときとかにしかふつうは使いません。
ランダムは全体のcDNAとかをチェックするときなどには有効だけど、今回は、あるかないかを判断するだけなので、スペシフィックなプライマーでRTしとかないと、RT後にプライマーの除去とかで二度手間だし、その後そもそもスペシフィックなプライマーでPCRするんやから意味なくね?とはいいましたよ。
— いいな (@iina_kobe) February 28, 2020
神戸大医学部で検体からRT PCRバンバンしてる嫁に、RTをかけるときにランダムプライマー使うの?って聞いたら、スペシフィックプライマーしか使わない。なんでランダム使うの?と逆質問されたので、回答お願いします。
— いいな (@iina_kobe) February 29, 2020
しかしながら、なぜか、ランダムプライマーは普通に使われている。とか、臨床検体のRNAは部分分解してたりするので、ランダムプライマーでのRTが有効です。とかいうちょっと意味の分からないリプをもらいましたので、それについてわかりやすく解説します。
そこはランダムプライマーでカバー
また、臨床検体のRNAは部分分解してたりするので、ランダムプライマーでのRTが有効です。
検査のプロトコール開発は、先ずcDNAの形で全体のRNAの情報を保存してから最適化するのでしょう詳しくはサーモフィッシャーのサイトなどで。https://t.co/e1QvgySiwL https://t.co/j65Zzk5lOg
— s_matashiro (@glasscatfish) February 28, 2020
スペシフィックプライマーとランダムプライマーの違い
今回は、簡単に説明するために、私がRTに使用しろと言っているスペシフィックプライマー NIID_WH-1_R913 Antisense 5’-CTTTACCAGCACGTGCTAGAAGG-3’ と、ランダムプライマーについてお話しします。
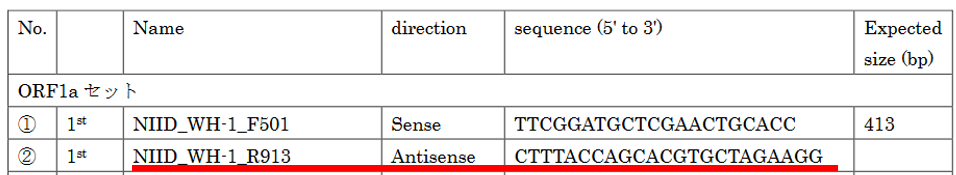
スペシフィックプライマー
このスペシフィックプライマー(配列がこのRNAウイルスにしかない特別なプライマー)はアンチセンス(逆配列)なので、実際にくっつく場所は、5’-CCTTCTAGCACGTGCTGGTAAAG-3’ という配列です。
実際の配列ではここにくっつきます。

この 5’-CTTTACCAGCACGTGCTAGAAGG-3’ が
この下図のようにくっつき、赤色の矢印の方向へcDNAが合成されます。
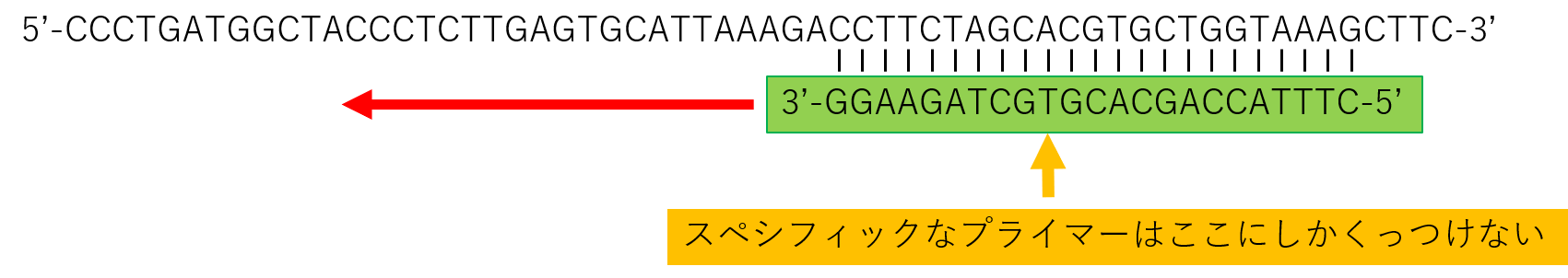
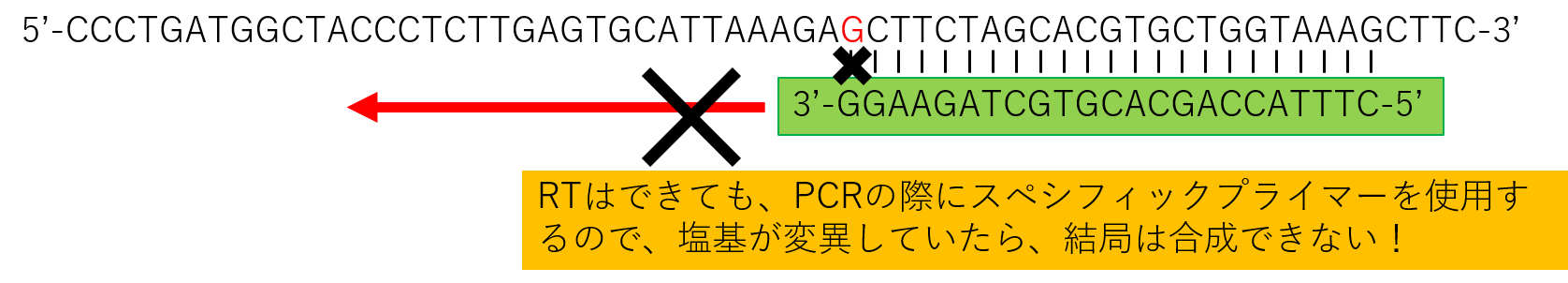
しかし、もし、ウイルスのRNAが壊れていたり、変異していた場合、下の図のようにRTがかからなくなります。
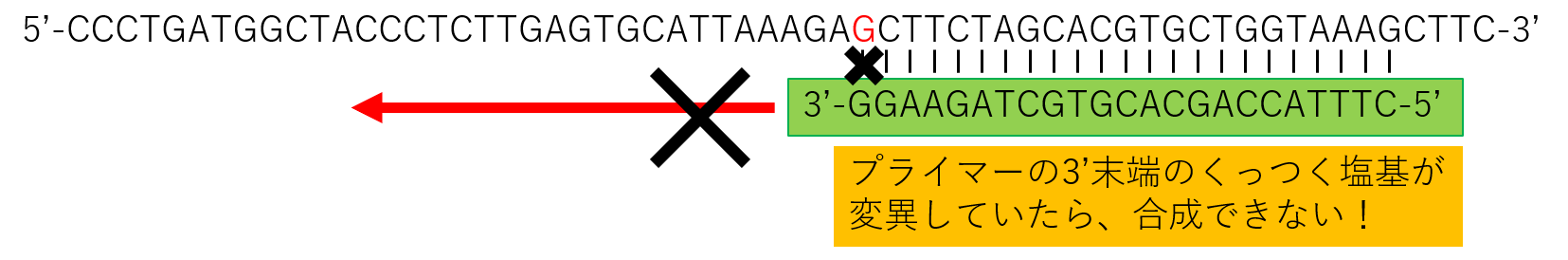
ですので、
元々RNAウイルスが変異していたら、スペシフィックプライマーでのRTのあとのPCRでは、DNAは増幅してきません。
ランダムプライマー
ランダムプライマーとは、4つの塩基からなるプライマーで、4つがマッチしていたらくっついてRTできます。
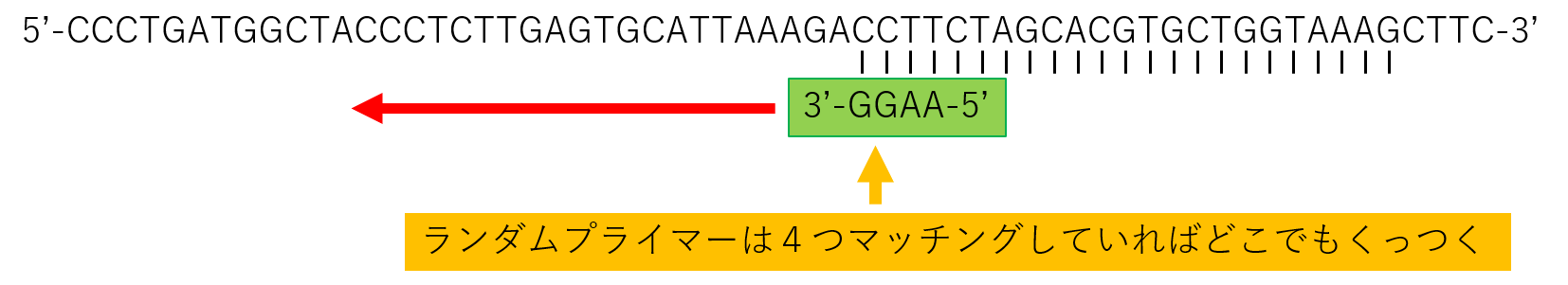
たとえ、ウイルスのRNAが壊れていたり、変異していた場合でも、変異した塩基に対応したランダムプライマーが下の図のようにくっつけるのでRTはかかります。
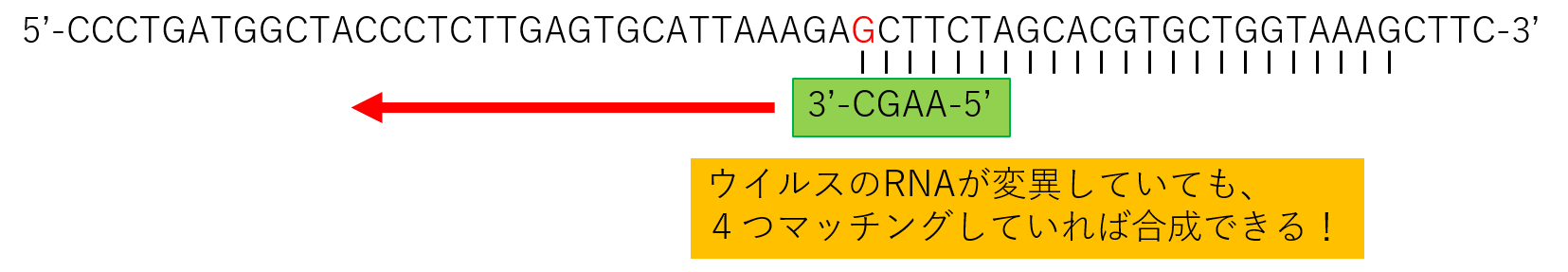
なので、スペシフィックプライマーをRTに使用するのと違って、RNAからcDNAの合成は可能なのです。
しかしながら、RTのあとのPCRはスペシフィックプライマーをどっちみち使用するので、変異した塩基にスペシフィックプライマーはくっつけないため、PCRはかからないのです。
ランダムプライマーはRTの後、取り除かなくてはいけない
スペシフィックなプライマーは、RT後のPCRにも使用するのでそのまま使えるのですが、ランダムなプライマーが入っている場合、PCRはランダムプライマーがくっつくところならどこからでも増えてくるので、ランダムプライマーを除去する必要が生じます。
もし、ランダムプライマーを除去せずにPCRを行えば、いろんな長さのDNAが増えてくるため、ゲルにDNAを流した場合、白く尾を引いたような汚い画像となります。
つまり、感染研のやり方でRTPCRをやると、汚くなり、偽陰性や擬陽性が出やすくなります。
まさにこの写真↓がそうだと思われます。
ぶっちゃけ、こんな汚い写真をよく載せたな。。。と思います。恥ずかしくないのか。。。
私のやった写真↓と比較するときれいさが違うのがわかると思います。
ですので、2ステップの「配列のわかっているもの」をRTPCRする場合は、スペシフィックプライマーを複数個使ってやって、たとえ変異が入っていてもちゃんとかかってくる保険をかけながらやるのが正確だし、それが感度をあげる方法だと思います。
そもそも、RNAが壊れてたとしてもプライマーの3末か4bp残ってたらランダムプライマーの代わりになるし、プライマー配列で補強できるから壊れもカバーできるんやが?ほんと、研究者なら意味不明な説明やめてほしい。
— いいな (@iina_kobe) February 28, 2020
なんで、そもそもspecificprimerでリバトラできないものがPCRで増幅すると考えるのだろうか、めっちゃ謎やわ。どういう論理や?壊れてたらランダムプライマーでかかっても、そもそもPCRで増えないやろ?その可能性をぬぐうために複数個のプライマーセットでやるんやろ?マジでわからない。
— いいな (@iina_kobe) February 28, 2020
そりゃ、感染研の作ったこのプロトコルなら感度30%~50%になるわなぁ。って思います。
論理的な反論あるのであれば、受付ます。
私ならこうする
厚労省の出したマニュアルはちょっとPCRがかかりにくいと思われます。
なので、私ならこうするというものを書いておきます。
RNA抽出
1・検体は痰などの肺に近い部分から取る。
2.RNAは迅速に取る。(これはキアゲンのキットを使えば15分くらいでできます。)
室温で15分置くなんて必要ないので、PBSでも何でもいいので懸濁したらすぐにトリゾールとかでRNAを取ってください。
100μlも取れれば十分です。
RT
RTは20μl系で
5×SSIV Buffer 4μl
specific primer (10μM) 3μl
dNTP (2mM each) 2μl
RNase Inhibitor 1μl
SuperScript IV Reverse Transcriptase 1μl
RNA 9μl
65℃ 5分
4℃ 1分
50℃ 10分
80℃ 5分
2-step RT-PCR
4.PCRはRT液を5μlテンプレートにして20μl系で
2×Quick Taq HS DyeMix 10μl
Forward primer (10μM) 1μl
Reverse primer (10μM) 1μl
cDNA 5μl
DDW 3μl
①と②のプライマーの組み合わせによるPCRは
94°C 1min
↓
94°C 30sec
59°C 30sec
72°C 30sec (1minで1000bp増えるので、今回は500bp増やしたいから)
これを35サイクル
↓
72°C 1min
4℃ で保存その後のnestedPCRは必要ないけど、やるんなんら、③と④のプライマーを使用し、上のPCR液を5μlテンプレートとして使用し、50μl系で、
94°C 1min
↓
94°C 30sec
53°C 30sec
72°C 30sec
これを25サイクル
↓
72°C 1min
4℃ で保存
電気泳動でチェック
⑦と⑧のプライマーの組み合わせによるPCRは
94°C 1min
↓
94°C 30sec
51°C 30sec
72°C 40sec (1minで1000bp増えるので、今回は550bp増やしたいから)
これを35サイクル
↓
72°C 1min
4℃ で保存必要ならば、nestedPCRには、⑨と⑩のプライマーを使用し、上のPCR液を5μlテンプレートとして使用し、50μl系で、
94°C 1min
↓
94°C 30sec
51°C 30sec
72°C 40sec
これを25サイクル
↓
72°C 1min
4℃ で保存
電気泳動でチェック
でします。
まあ、わたしがするなら、そもそもプライマーの設計をやり直しますけどね。。。
プライマーを作ってみた 追記 2020.3.30
以前、このRTPCRするなら私ならこんなプライマーを作る!って思って作ったやつがありますので、載せておきます。
P1 ORF1 5’-AGCCTTGTCCCTGGTTTCAACGAG-3’ TM59 24mer
P2 ORF1 5’-GTCAATAAAGTCCAGTTGTTCGGAC-3’ TM57 25mer
663bp の増幅産物
P1 SP1 5’-CCAAAATGCACAAGCTTTAAACACGCTTG-3’ 29mer TM59
P2 SP1 5’-AATTCTTGGCAACCTCATTGAGGCG-3’ 25mer TM59
719bp の増幅産物


